MANUALE di AGGREGAZIONE PIASTRINICA
SABATO 6 MARZO 2021
Roberto ha detto:
ESEMPIO DI CALCOLO DELLA MVD e della mvc Gel Clot
-Sensibilità del lisato 0,06
-Limite di Endotossina per il prodotto da analizzare 3.0 EU/ml
MVD = 3.0 EU/ml / 0.06 EU/ml
– Cinetico Cromogenico
-Standard a conc. più bassa 0.005 EU/ml
-Limite di ENdotossina per il prodotto da analizzare 3.0EU/ml
MVD = 3.0 EU/ml / 0.005 EU/ml
mvc ( minima valida concentrazione )
– Il grado al quale il prodotto può essere diluito è espresso anche come mvc
– mvc è utilizzata quando i limiti di endotossina sono espressi in EU/ml .
MANUALE OPERATIVO DI AGGREGAZIONE PIASTRINICA
Drai bath-laboratorio
13/05/2021
AGGREGAZIONE PIASTRINICA
Adesione delle Piastrine , alla struttura sottoendoteliali delle pareti vasali danneggiate , principalmente , alle fibre Collagene, ma anche ad altre strutture , come ad esempio le membrani basali.
 la foto è stata presa da:
la foto è stata presa da:Sentieri della medicina
Piasrine
Reazione di Realise , cui vanno incontro le piastrine adese alle fibre di Collagene .
Tale reazione consiste in una liberazione esplosiva , nel medium circolante , di molte sostanze endopiastriniche , come ADP e l' ATP , la serotonina , il fattore piastrinico 4 , il fibrinogeno , Ca , ioni ed altre ancora .
COLLAGENE
E' una proteina essenziale costituita delle fibre bianche ( fibre di collagene a contrazione rapida ) ed
è costituente di tessuto connettivo .
Circa un quarto di tutte le proteine del nostro corpo è COLLAGENE .
Il COLLAGENE è la più importante proteina strutturale e forma cavi molecolari che rinforzano i tendini e fogli grandi ed elastici che sostengono la pelle e gli organi interni.
ADP
L' ADP è il principale responsabile dell'aggregazione piastrinica .
E' proprio questo meccanismo che può essere artificialmente riprodotto in Vitro
Lo studio dell'aggregazione piastrinica viene eseguita con il metodo NEFELOMETRICO che si rifà alle metodiche di Born G.V.R. e di O'Brien, J.R.,Heywood,J.B.,Heady,J.A.
E' bene comunque , prima di addentrarmi nell'argomento , chiarire alcuni concetti di base.
Per aggregazione piastrinica si intende la proprietà delle Piastrine di aderire l'un l'altra , mentre col termine di Adesività Piastrinica si indica la proprietà delle stessa cellule , di aderire ad una superfice estranea.
Viene peraltro usato il termine di adesività e aggregazione delle Piastrine in quanto queste due funzioni sono , in -Vitro ed in-Vivo , chiaramente correlate nella loro genesi , ed anche perché molti tests in vitro non riescono a separare nettamente questi due fenomeni
INTRODUZIONE
Aggregazione Piastrinica
Lo studio dell' aggregazione piastinica viene eseguito con il Metodo NEFELOMETRICO
che si rifa' alle metodiche di Born e di O'Brien .
E' bene comunque , prima di addentrarmi nell'argomento , chiarire alcuni concetti di base .
- Roberto MVD – mvc –ESEMPIO DI CALCOLO DELLA MVD – Gel Clot -Sensibilità del lisato 0,06 -Limite endotossinico..
Generalità
Le reazioni avverse alla somministrazione dei preparati parenterali sono state descritte fin dal XIX secolo ed inizialmente denominate “febbre da iniezione”. Tali reazioni derivavano dall’iniezione, insieme al farmaco, di sostante note con il termine pirogeni: sostanza che nell’uomo o nell’animale provocano un aumento della temperatura corporea con le stesse caratteristiche della febbre.
Oggi è noto che i pirogeni sono un gruppo eterogeneo di sostanze di origine microbica e non, fra cui le più importanti e più conosciute sono le endotossine o lipopolisaccaridi (LPS) derivanti dai batteri gram-negativi. Anche piccole dosi di endotossine provocano infatti una risposta infiammatoria nell’uomo e, quando entrano nel flusso sanguigno, possono indurre risposte deleterie incluso shock settico o persino la morte. L’LPS viene rilasciato dalla parete cellulare dei batteri gram-negativi in crescita o quando questi vengono uccisi da antibiotici o dal sistema immunitario dell’ospite.
La riconosciuta pericolosità delle endotossine portò all’inserimento del test all’interno delle Farmacopea, fra cui quella europea. Le farmacopee stabiliscono infatti che per i prodotti farmaceutici iniettabili si debba garantire un contenuto endotossinico tale da non causare reazioni febbrili (E.P 5.1.10) e stabiliscono i metodi per la loro determinazione (E.P 2.6.14). Il Test più utilizzato è proprio il LAL test, esso si basa sull’utilizzo del lisato di amebociti prelevati dal sangue di granchi a ferro di cavallo, i Limulus polyphemus.
Principio
Fred Bang, nel 1956, osservò che l’infezione del granchio Limulus polyphemus con batteri Gram-negativi provocava una coagulazione intravascolare, dovuta ad una reazione tra endotossina e una proteina di coagulazione. A partire da questa scoperta F. Bang e J. Levin inventarono il test delle endotossine.

Oggi esistono principalmente tre metodologie per il test LAL (Limulus Amebocyte Lysate):
- gel-coagulo o gel-clot;
- test turbidimetrico;
- test cromogenico.
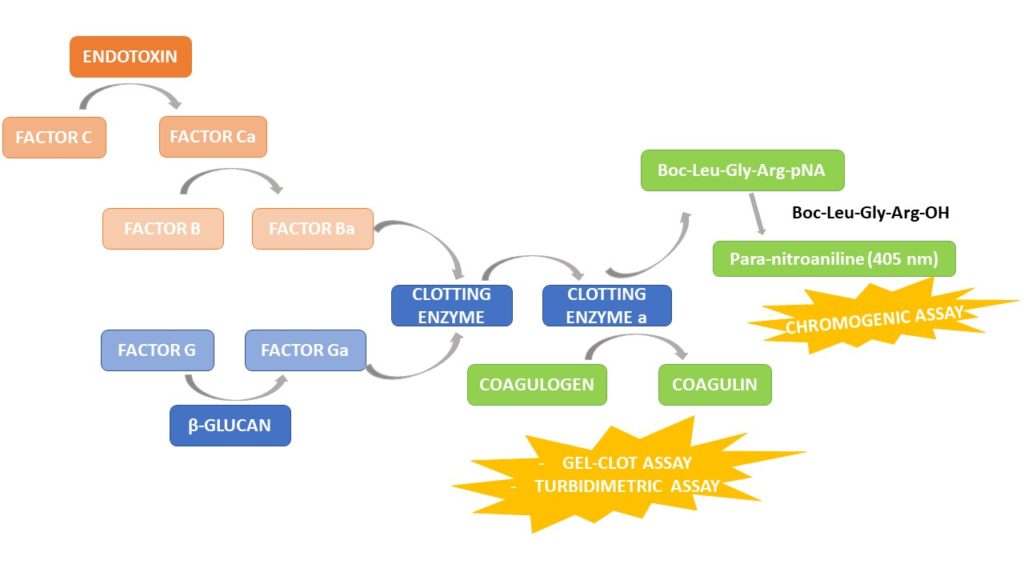
Tutti e tre i metodi si basano sulla stessa cascata di reazione mediata da LPS nel limulus che vede la presenza di diversi attori: proenzimi serina proteasi (fattore C, fattore B), un proenzima proclottante e una proteina gelificante, il coagulogeno.
L’LPS attiva dapprima il proenzima fattore C alla forma attiva del fattore C. il fattore C attivato, attiva a sua volta il fattore B, il quale converte l’enzima proclottante in enzima coagulante. L’enzima di coagulazione attivato scinde due legami peptidici nel coagulogeno, una molecola simile al fibrinogeno, per produrre un gel di coagulina insolubile. La cascata della coagulazione, oltre che dall’endotossina, viene anche attivata dall’(1,3) – β -D-glucano che attiva il proenzima fattore G portando all’attivazione dello stesso enzima proclottante.

Test Cromogenico
L’enzima di coagulazione attivato dall’endotossina scinde un substrato cromogenico sintetico, utilizzato specificatamente per il dosaggio delle endotossine batteriche Boc-Leu-Gly-Arg- p -nitroanilide (pN/A), rilasciando la p-nitroanilina di colore giallo. Il colore generato viene misurato fotometricamente a 405 nm. La quantità di endotossina nel campione è determinata dal tempo richiesto l’apparizione del colore giallo.
Test Gel-clot
La presenza di endotossina attiva l’enzima di coagulazione generando la formazione un coagulo di gel nel campione.
Test Turbidimetrico
Il test turbidimetrico misurata la presenza di particelle solide in una soluzione, ovvero la torbidità. In presenza di endotossina, il lisato svilupperà torbidità dovuta al taglio del substrato endogeno da parte dell’enzima proclottante attivato. La torbidità viene letta come valore di densità ottica (OD) pari circa a 340 nm. La velocità di sviluppo della torbidità è direttamente proporzionale alla concentrazione di endotossina presente nel campione.
Metodo
Inhibition/enhancement test
Per ciascun prodotto in analisi, preliminarmente all’esecuzione del test delle endotossine, è necessario eseguire una qualifica iniziale del metodo, chiamata anche “inhibition/enhancement testing“, al fine di individuare le condizioni idonee per l’analisi (diluizione e diluente) che minimizzino le interferenze con i risultati del test. Generalmente il campione viene testato a diverse diluizioni fino alla massima diluizione valida o MVD utilizzando diversi diluenti. L’MVD rappresenta la massima diluizione del campione che consente di determinare una quantità di endotossina pari al limite di endotossina stabilito. Essa dipende quindi dal limite di endotossina stabilito per il prodotto (EL), dalla concentrazione del prodotto (generalmente la concentrazione del principio attivo) e dalla sensibilità del metodo scelto (λ). L’MVD viene calcolata come:
MVD =(Endotoxin Limit)×(Product Concentration) / λ
Il limite di endotossina o EL rappresenta la quantità di endotossina che può essere contenuta in un prodotto senza rappresentare un pericolo per la salute del paziente. Il calcolo del limite di endotossina per qualsiasi farmaco dipende da tre variabili:
- la via di somministrazione;
- la dose di prodotto somministrato per chilogrammo di peso corporeo;
- la durata (tempo) della somministrazione.
Esso viene calcolato come di seguito:
EL= K/M
Dove, K = dose soglia di pirogeni e M = dose massima raccomandata di prodotto per chilogrammo di peso corporeo del paziente.
I capitoli delle farmacopee relativi al test delle endotossine riportano delle tabelle che dettagliano il valore di K e M da considerare per ciascuna tipologia di prodotto.
In aggiunta durante la fase di qualifica del metodo, è necessario verificare che il valore di pH della mistura campione e lisato sia contenuto all’interno del range 6.0-8.0, qualora ricadesse al di fuori dell’intervallo deve essere aggiustato con le apposite soluzioni tampone.
A questo punto, identificate le condizioni migliori per il test, si può procedere all’esecuzione del test in routine.
LAL test – metodo cinetico cromogenico
Il campione da analizzare, tal quale o diluito, viene dispensato in una piastra da 96 pozzetti e mescolato con un’uguale quantità del reagente LAL. Il reagente LAL contiene il lisato derivato dagli amebociti del granchio a ferro di cavallo e il substrato cromogenico sintetico.
Nella stessa piastra viene preparata una curva standard composta generalmente da 3 o 4 punti a concentrazione nota di endotossina. La piastra preparata viene inserita in un lettore di micropiastre, ad una temperatura di 37°C e la comparsa del colore giallo viene monitorata nel tempo misurando l’assorbanza a 405 nm. Il tempo necessario per la comparsa del colore giallo, chiamato tempo di reazione, è inversamente proporzionale alla quantità di endotossina presente. La quantità di endotossina viene calcolata sulla base del suo tempo di reazione confrontandola con la curva standard. Il metodo cromogenico può essere di tipo cinetico oppure end-point: con il metodo LAL cromogenico cinetico, viene determinata la comparsa della reazione di colorazione in funzione del tempo mentre nel caso del metodo endo-point si esegue la lettura di assorbanza in un determinato punto temporale.
LAL test – Metodo Gel-Clot
Il metodo gel-clot viene eseguito introducendo in una provetta sterile e apirogena un volume nell’ordine dei microlitri di campione in esame e di reagente LAL. La soluzione viene agitata vigorosamente per circa 30 secondi e poi incubata a 37 °C per un’ora, durante la quale è necessario prestare attenzione a non muoverla. Trascorso il tempo la presenza di endotossina viene determinata osservando la formazione del coagulo di gel. La concentrazione minima di endotossina necessaria per causare la coagulazione in condizioni standard dipende dalla sensibilità del lisato scelta.
LAL test – Metodo Turbidimetrico
La procedura generale prevede la misurazione della lunghezza d’onda della luce che passa attraverso la soluzione usando metodi spettrofotometrici. Il metodo turbidimetrico può essere di tipo cinetico oppure end-point: con il metodo LAL turbidimetrico cinetico, viene determinato l’incremento quantitativo della torbidità mentre nel caso del metodo end-point si esegue la lettura della torbidità in un determinato punto temporale.
Il test richiede l’impiego di una specifica strumentazione per incubare i campioni ad una temperatura controllata di 37°C e per leggere i valori di OD ad intervalli regolari. Il campione in esame viene dispensato all’interno di una micropiastra e mixato con una quantità di reagente LAL. All’interna della piastra viene preparata una curva standard costruita con diverse concentrazioni note di endotossina standardizzata. Le curve standard, costruite tracciando il logaritmo del tempo di inizio in funzione del logaritmo della concentrazione di endotossina standard, vengono usate per calcolare le concentrazioni di endotossina nel campione di analisi. La sensibilità dell’analisi turbidimetrica dipende dal lisato scelto: è possibile determinare fino a 0.001 EU/ml
Risultati attesi
LAL test – Metodo cromogenico
In presenza di endotossina all’interno del campione si verifica la reazione che genera la colorazione gialla. Il tempo di reazione è inversamente proporzionale alla quantità di endotossina presente nel campione: quando il campione presenta una quantità elevata di endotossina la reazione avviene rapidamente, in presenza di una quantità di endotossina inferiore, il tempo di reazione aumenta. Il metodo cromogenico è estremamente sensibile, è possibile determinare fino a 0.001 EU/ml. Generalmente il software restituisce il risultato in EU/ml per ciascun campione analizzato calcolando la concentrazione di endotossina per confronto con la curva standard.

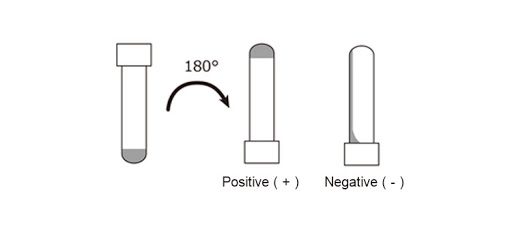
LAL test – Metodo Gel-Clot
Terminata l’analisi viene capovolta la provetta:
- se la soluzione non si stacca dal fondo, il campione contiene endotossine e il LAL si è coagulato.
- Se la soluzione si stacca dal fondo, il campione non contiene endotossine.
LAL test – Metodo turbidimetrico
In presenza di endotossine nel campione, si verifica la reazione di coagulazione del reagente LAL, la quale produce una massa solida nella soluzione. Si otterrà di conseguenza un grado di torbidità maggiore rispetto al campione in assenza di endotossina. Anche in quest’ultimo l’incremento della torbidità è direttamente proporzionale alla quantità di endotossina presente nel campione ed il risultato viene elaborato dal software per confronto con la curva standard.
Si stanno oggi affacciando sulla scena tecnologie più rapide e sostenibili per il test cinetico cromogenico come il sistema a cartucce, nel quale tutti i reagenti necessari per il test sono caricati all’interno della cartuccia stessa. L’analista deve caricare il campione, diluito o tal quale, all’interno dei pozzetti della cartuccia ed in soli 15 minuti è possibile ottenere un risultato di tipo quantitativo.







Orto : come mangiare verdure e frutta a km 0
RispondiElimina